Primer fármaco contra el alzhéimer: de cómo el villano resultó ser héroe
Así actúa en el cerebro lecanemab, un medicamento nacido en medio de una enorme controversia, que se ha convertido en la gran esperanza de millones de familias
Venía el diablo y resultó ser que no. Lecanemab, el primer fármaco realmente eficaz diseñado específicamente contra el alzhéimer, nació envuelto en la peor de ... las polémicas posibles. El ángel de la esperanza cayó a los infiernos al descubrirse que el preparado había provocado atrofia cerebral a algunos de los afectados, justo lo contrario de lo que se buscaba. La sospechosa muerte de dos de los más de 1.700 voluntarios que participaban en el ensayo del fármaco acabó por avivar aún más las llamas del infierno.
Una cumbre en Bilbao con los mayores neurocientíficos de Europa puso de manifiesto en la primavera del año pasado la división que el preparado generaba entre los expertos. Frente a quienes defendían el valor del primer medicamento capaz de hacer frente a la enfermedad figuraban quienes se amparaban en sus limitaciones para defenestrarlo. Era algo contra nada, pero la esperanza se tiñó de sombras.
La división inicial entre la agencia estadounidense del medicamento (FDA) y la europea tampoco ayudó demasiado. La institución del país de las barras y estrellas decidió apostar por lo que hay y autorizó su uso. A partir de ahí, asociaciones profesionales y de pacientes de Europa se pusieron en pie y forzaron a la EMA a cambiar el paso. Con condiciones, pero adelante. «En medicina siempre ocurre así, el primer fármaco nunca suele ser perfecto. Luego, poco a poco, se va mejorando, y acaban apareciendo otros cada vez más cómodos y eficaces», reflexiona la especialista Raquel Sánchez del Valle, coordinadora del Grupo de Estudio de Conducta y Demencias de la Sociedad Española de Neurología (SEN). De su mano, este periódico analiza la manera en que actúa el nuevo preparado para mejorar la calidad de vida de los pacientes.
El villano es ya un héroe llamado a poner el primer freno a la más común de las demencias. Para el año 2050, dentro de tan solo 25, que no es nada, se prevé que los afectados por enfermedades neurodegenerativas en el mundo se multipliquen por tres. Los 57 millones de ciudadanos del planeta dañados por ellas pasarán a ser 153 millones. O tal vez no... Quizás lo impidan lecanemab y sus hijos. Los primeros de ellos están a punto de nacer.
El nacimiento de la demencia
Las responsables de la enfermedad de alzhéimer son dos proteínas absolutamente necesarias para el buen funcionamiento del cerebro. Se llaman tau y beta-amiloide o simplemente amiloide. A la que tiene nombre de equipo de baloncesto, el principal órgano del sistema nervioso central le tiene encargada una misión clave. Mantiene una «red de tuberías» (estructura microtubular, se llama) que favorece la comunicación entre las neuronas. Además, contribuye a la generación de nuevas células y las protege de la muerte. El cerebro la necesita.
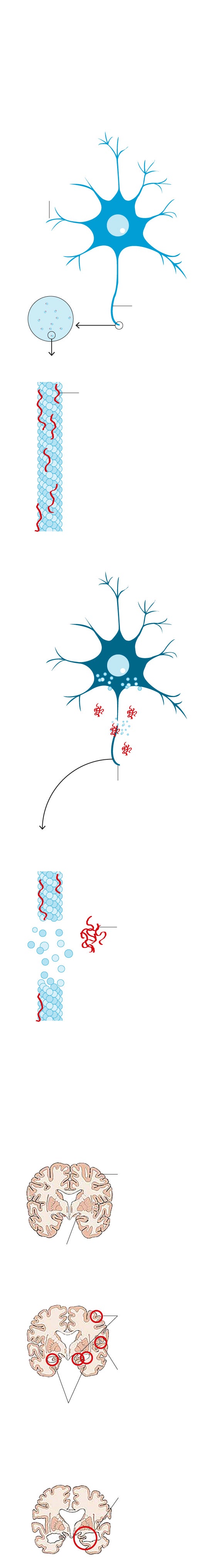
1. ORIGEN DEL ALZHÉIMER
Existen dos proteínas cuya acumulación en el cerebro está directamente relacionada con el alzhéimer. La Beta-amiloide o amiloide y la Tau.
NEURONA SANA
Dendritas
Axón sano
Microtúbulo sano
Proteína Tau. Mantiene la integridad de los microtúbulos y la circulación de la señal.
NEURONA ENFERMA
Axón enfermo, no puede realizar el transporte neuronal
Microtúbulo desintegrándose
Placa extraneuronal de proteína beta-amiloide
Disfunción sináptica. Se ven afectadas las uniones a través de las cuales se comunican dos neuronas.
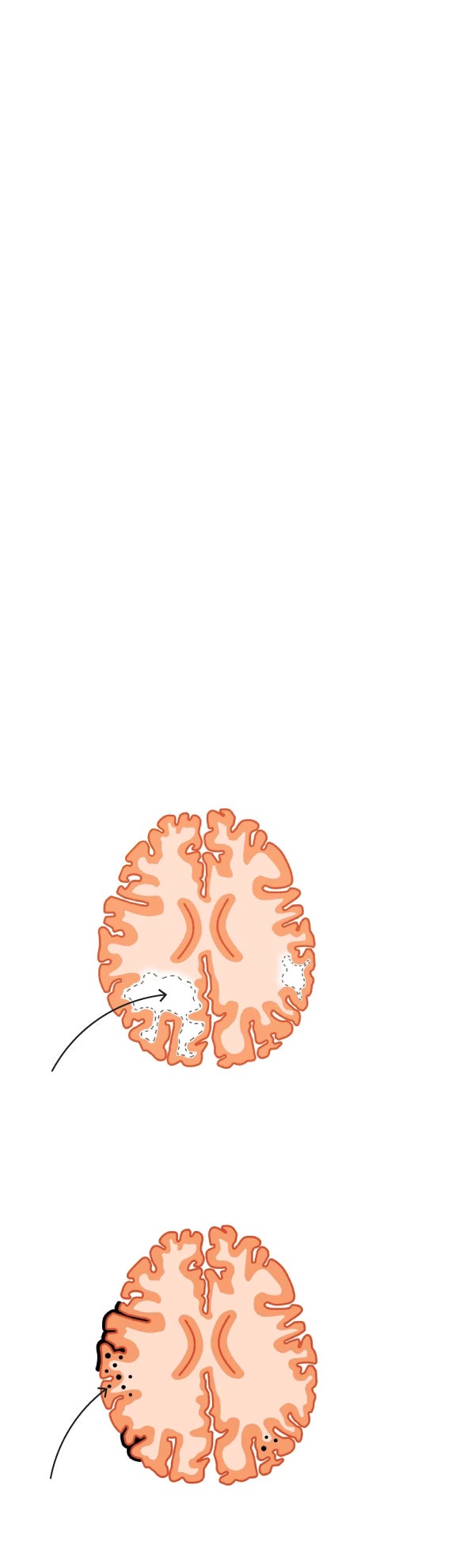
AVANCE DE LA ENFERMEDAD
Cerebro sano
Corteza cerebral
Hipocampo
1. Etapa leve
Contracción cortical y del hipocampo
Los surcos se intensifican
Ventrículos medianamente agrandados
2. Etapa avanzada
Disminución grave del tamaño del cerebro
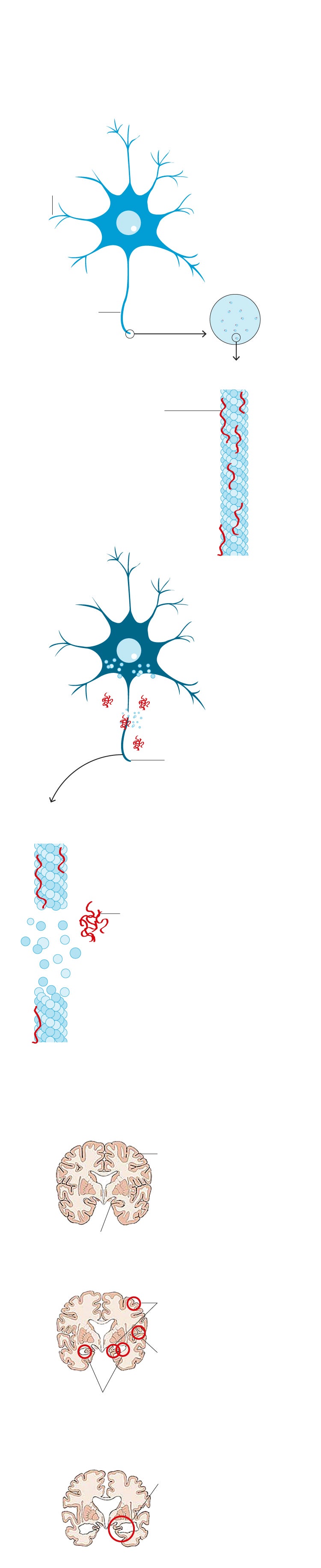
1. ORIGEN DEL ALZHÉIMER
Existen dos proteínas cuya acumulación en el cerebro está directamente relacionada con el alzhéimer. La Beta-amiloide o amiloide y la Tau.
NEURONA SANA
Dendritas
Axón sano
Microtúbulo sano
Proteína Tau. Mantiene la integridad de los microtúbulos y la circulación de la señal.
NEURONA ENFERMA
Axón enfermo, no puede realizar el transporte neuronal
Microtúbulo desintegrándose
Placa extraneuronal de proteína beta-amiloide
Disfunción sináptica. Se ven afectadas las uniones a través de las cuales se comunican dos neuronas.
AVANCE DE LA ENFERMEDAD
Cerebro sano
Corteza cerebral
Hipocampo
1. Etapa leve
Contracción cortical y del hipocampo
Los surcos se intensifican
Ventrículos medianamente agrandados
2. Etapa avanzada
Disminución grave del tamaño del cerebro
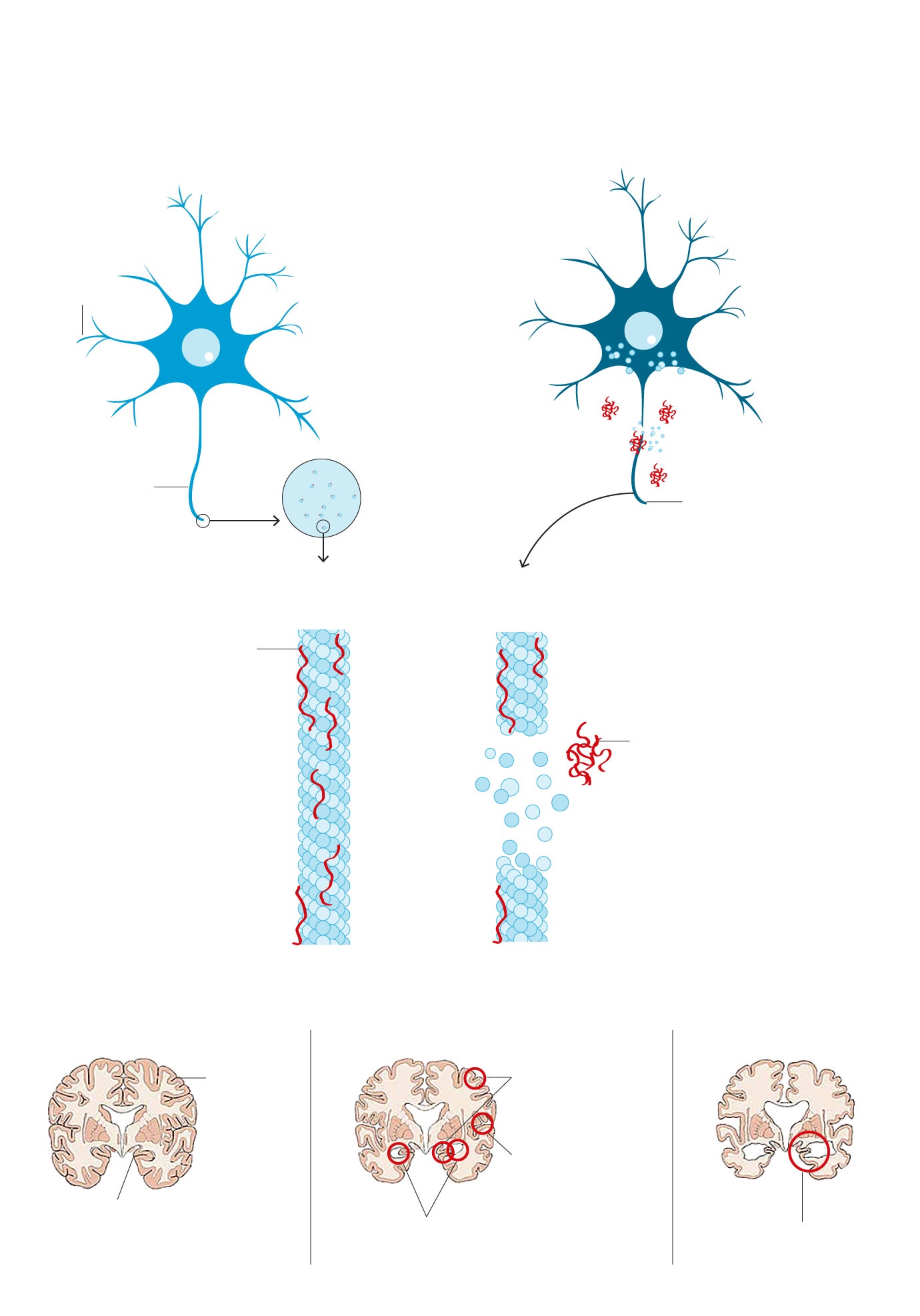
1. ORIGEN DEL ALZHÉIMER
Existen dos proteínas cuya acumulación en el cerebro está directamente relacionada con el alzhéimer. La Beta-amiloide o amiloide y la Tau.
NEURONA SANA
NEURONA ENFERMA
Dendritas
Axón enfermo, no puede realizar el transporte neuronal
Axón sano
Microtúbulo sano
Microtúbulo desintegrándose
Proteína Tau. Mantiene la integridad de los microtúbulos y la circulación de la señal.
Placa extraneuronal de proteína beta-amiloide
Disfunción sináptica. Se ven afectadas las uniones a través de las cuales se comunican dos neuronas.
AVANCE DE LA ENFERMEDAD
Cerebro sano
1. Etapa leve
2. Etapa avanzada
Contracción cortical y del hipocampo
Corteza cerebral
Los surcos se intensifican
Hipocampo
Ventrículos medianamente agrandados
Disminución grave del tamaño del cerebro
También a la beta-amiloide. La función de esta última es fundamentalmente reparadora de daños cuando se sufre un traumatismo cerebral, por pequeño que sea... Hasta que se desata un desastre en cadena. No se sabe muy bien por qué, en un momento determinado de la vida, la generación de unas y otras comienza a multiplicarse de manera desordenada. La acumulación de proteínas tau genera ovillos neuronales y la de amiloide, placas. «Es una acumulación de acontecimientos que comienza mucho años antes de que el paciente tenga síntomas», explica de manera gráfica Raquel Sánchez del Valle.
Causa o consecuencia del alzhéimer, ambos fenómenos se convierten en definitorios de la enfermedad. El cerebro del paciente comienza a nublarse. Aparecen los primeros olvidos. No es que no se recuerde dónde se dejaron las llaves. Es que, de pronto, uno se desorienta en su casa o se olvida de que ha nacido su nieta. «¡Y no me habéis dicho nada!»
Como actúa lecanemab
Lecanemab es una proteína diseñada en laboratorio (anticuerpo monoclonal), que actúa contra una de esas dos proteínas, la beta-amiloide. Activa el sistema de defensas contra ellas y logra despegar del cerebro las placas de proteína que lo dañan. De su degradación y completa eliminación se ocupa luego el equipo de limpieza celular del cuerpo humano (macrófagos), que devora los restos.
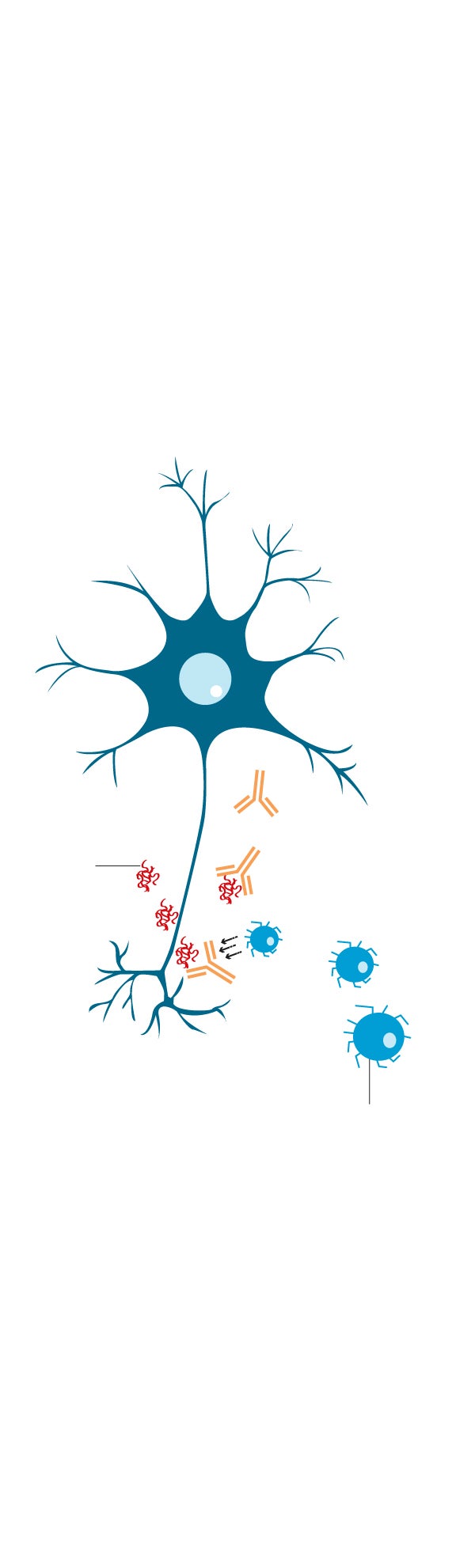
2. CÓMO ACTÚA LECANEMAB
El nuevo medicamento es un anticuerpo monoclonal (proteína de laboratorio), que se administra por vena. Activa mecanismos del sistema de defensas que despegan las placas de amiloide acumuladas en el cerebro. El sistema de limpieza de este órgano se ocupa de su eliminación.
De momento, no hay certeza sobre su acción frente a tau.
Anticuerpos de lecanemab
2
Placa amiloide
1
3
Célula inmune
1
La proteína amiloide se acumula alrededor de las neuronas del cerebro.
2
El anticuerpo lecanemab se adhiere a la proteína amiloide.
3
El anticuerpo atrae las células inmunes para descomponer la proteína y así romper las placas amiloides.
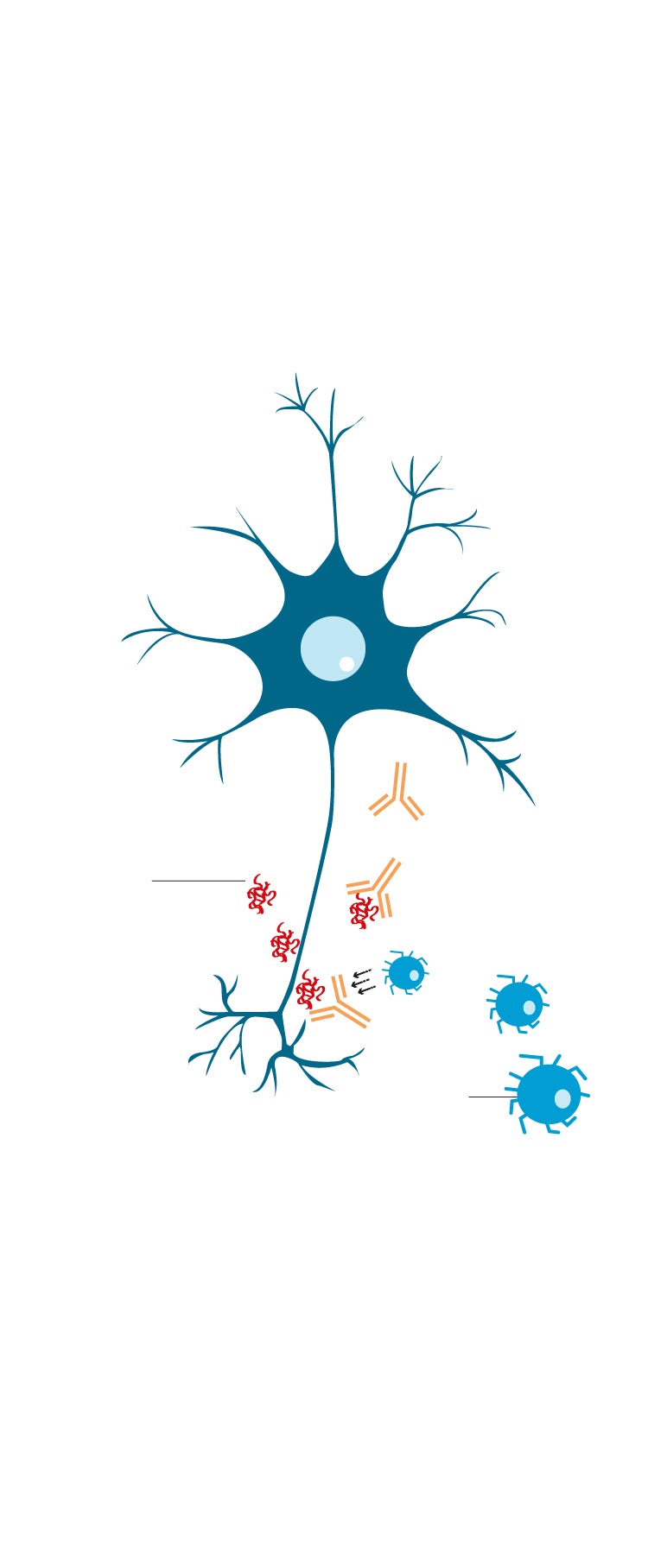
2. CÓMO ACTÚA LECANEMAB
El nuevo medicamento es un anticuerpo monoclonal (proteína de laboratorio), que se administra por vena. Activa mecanismos del sistema de defensas que despegan las placas de amiloide acumuladas en el cerebro. El sistema de limpieza de este órgano se ocupa de su eliminación.
De momento, no hay certeza sobre su acción frente a tau.
Anticuerpos de lecanemab
2
Placa amiloide
1
3
Célula inmune
1
La proteína amiloide se acumula alrededor de las neuronas del cerebro.
2
El anticuerpo lecanemab se adhiere a la proteína amiloide.
3
El anticuerpo atrae las células inmunes para descomponer la proteína y así romper las placas amiloides.
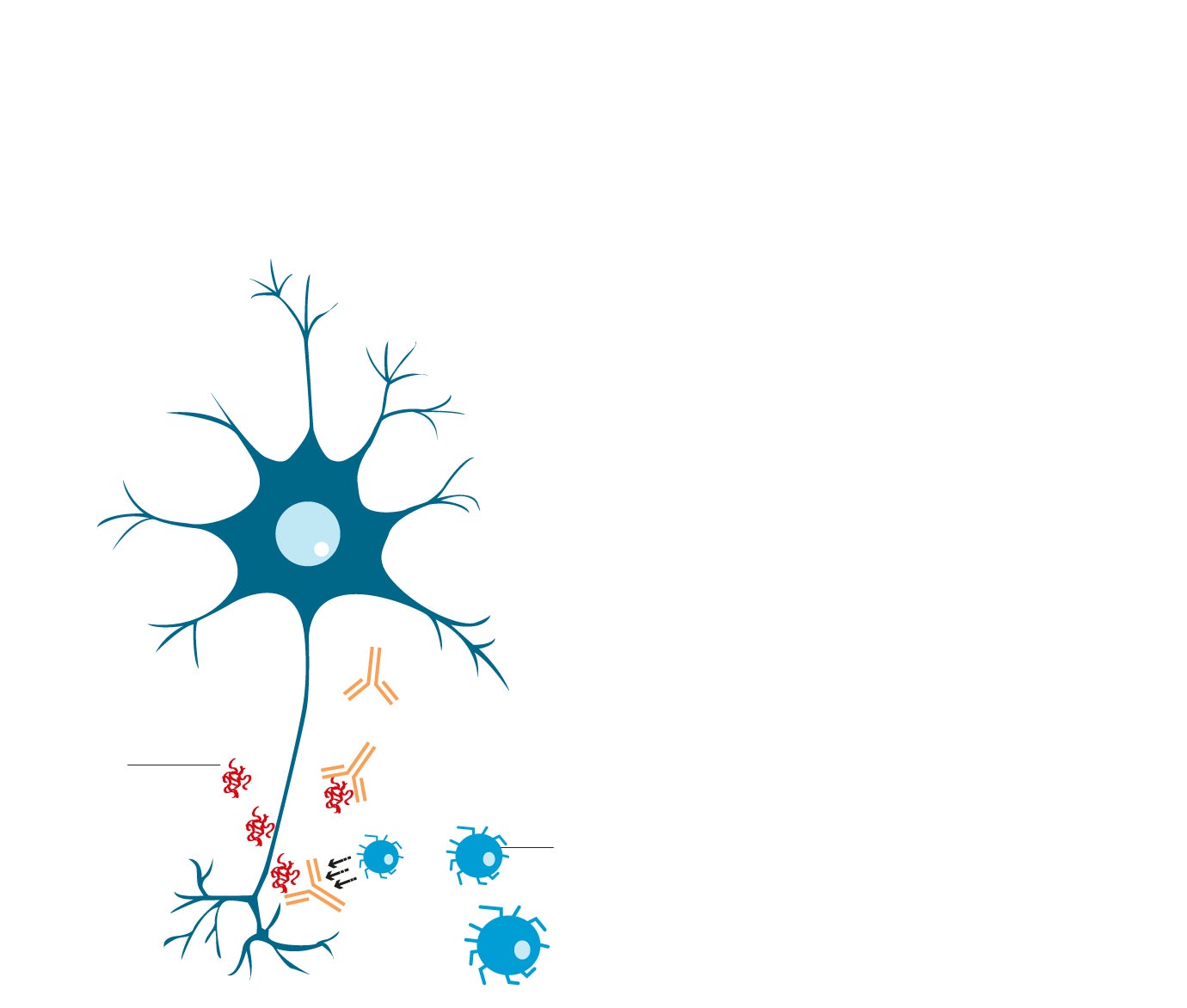
2. CÓMO ACTÚA LECANEMAB
El nuevo medicamento es un anticuerpo monoclonal (proteína de laboratorio), que se administra por vena. Activa mecanismos del sistema de defensas que despegan las placas de amiloide acumuladas en el cerebro. El sistema de limpieza de este órgano se ocupa de su eliminación.
De momento, no hay certeza sobre su acción frente a tau.
1
La proteína amiloide se acumula alrededor de las neuronas del cerebro.
2
El anticuerpo lecanemab se adhiere a la proteína amiloide.
3
El anticuerpo atrae las células inmunes para descomponer la proteína y así romper las placas amiloides.
Anticuerpos de lecanemab
2
Placa amiloide
1
Célula inmune
3
«Digamos para que se entienda que actúa como si fuese un disolvente de grasa», detalla la especialista. El fármaco sólo retrasa unos meses los primeros síntomas del alzhéimer. Su uso solo se recomienda, por ello, en etapas iniciales. ¿Por qué no después? «Porque a día de hoy no tenemos medios para restablecer la comunicación rota entre las neuronas», explica la neuróloga de la SEN. «Ahora tenemos algo que impide el daño inicial, no que corrige los efectos que tiene el mantenimiento durante años de ese daño. No podemos resucitar las neuronas muertas».
Efectos secundarios y controversia
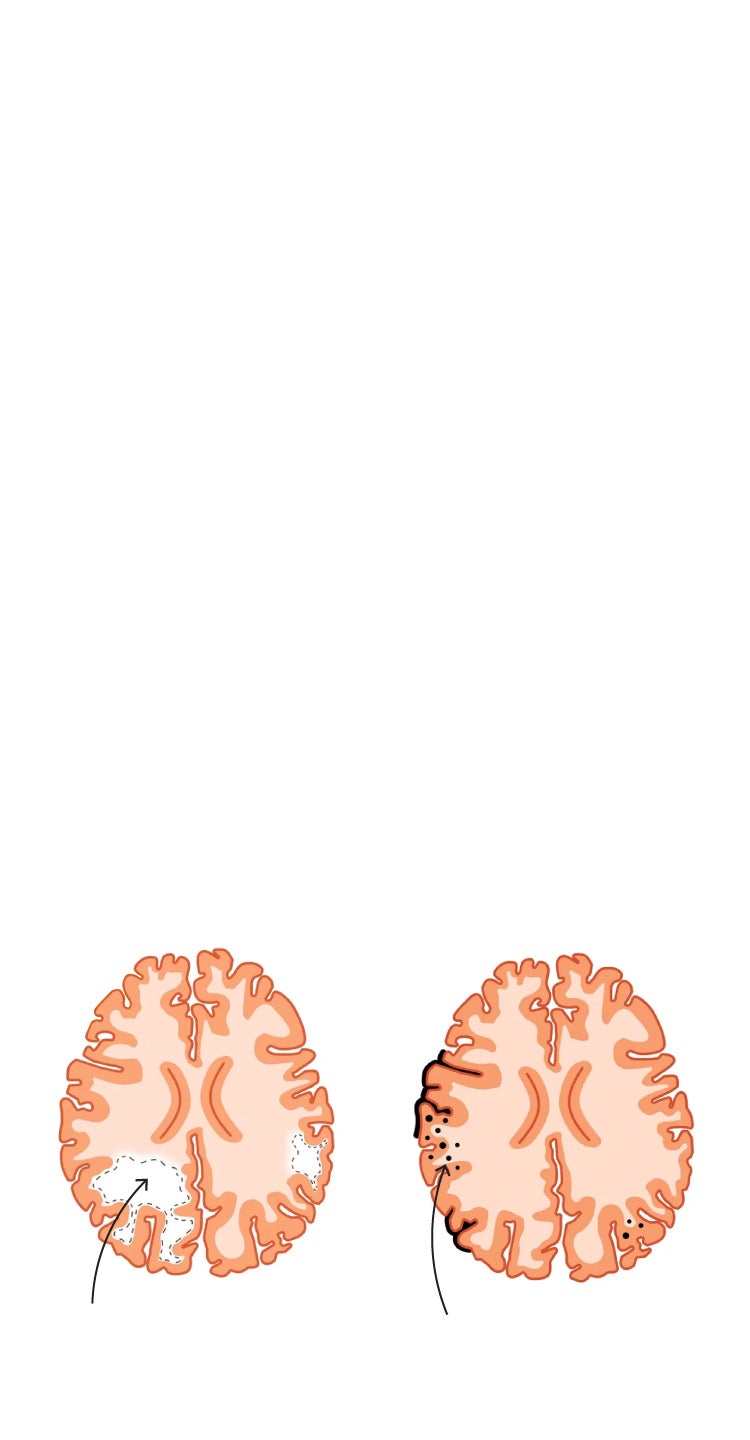
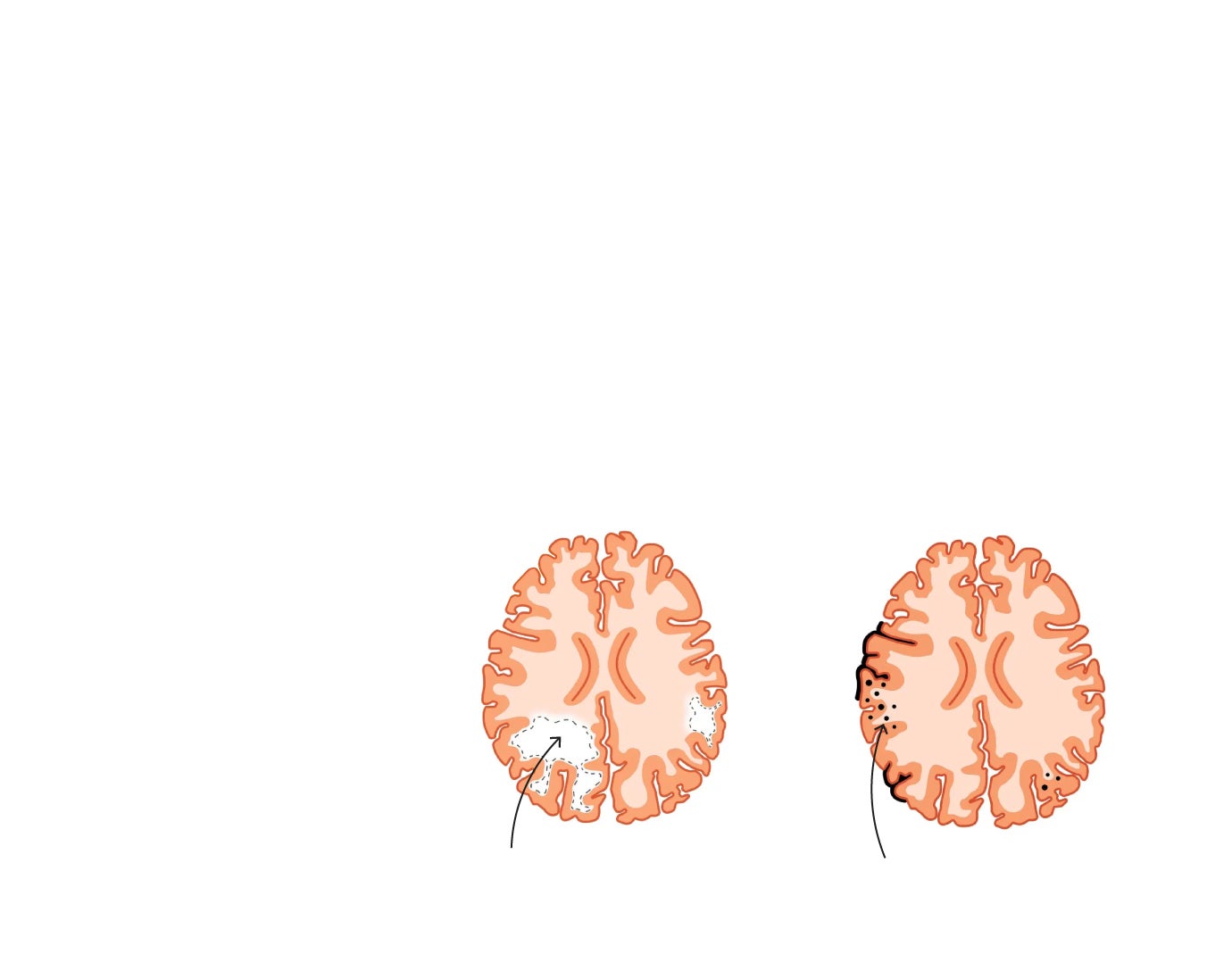
El nuevo preparado es de momento de aplicación por vena (vía endovenosa), lo que obliga a su administración únicamente hospitalaria. No es el mayor problema. Su uso puede provocar en un número reducido de pacientes, entre el 2% y el 3%, dos fenómenos graves, que pueden controlarse. Uno de ellos es la inflamación, que es la respuesta natural del sistema inmune para localizar y reparar daños. Cuando esa restauración resulta inviable, la inflamación se convierte en crónica; lo que es una señal de daño en el ADN y riesgo de enfermedades complejas, como el cáncer. En el caso del cerebro es una puerta abierta a la demencia. «Imagine que está limpiando una sartén. El estropajo quita la grasa, pero si te pasas, la rayas».
3. EFECTOS SECUNDARIOS
La labor de limpieza del lecanemab puede provocar una irritación, una inflamación al intentar despegar las placas amiloides o una hemorragia si la zona en la que incide es sobre los vasos sanguíneos.
2-3%
de los pacientes favorece la inflamación del cerebro y riesgo de sangrado (ictus)
¿Qué son las ARIA?
Son cambios en el cerebro visibles en la resonancia magnética que pueden ocurrir después del uso de anticuerpos amiloides.
ARIA-E
(edema)
Edema y/o derrame sulcal
ARIA-H
(hemorragia)
Microhemorragias
3. EFECTOS SECUNDARIOS
La labor de limpieza del lecanemab puede provocar una irritación, una inflamación al intentar despegar las placas amiloides o una hemorragia si la zona en la que incide es sobre los vasos sanguíneos.
2-3%
de los pacientes favorece la inflamación del cerebro y riesgo de sangrado (ictus)
¿Qué son las ARIA?
Son cambios en el cerebro visibles en la resonancia magnética que pueden ocurrir después del uso de anticuerpos amiloides.
ARIA-E
ARIA-H
(edema)
(hemorragia)
Edema y/o derrame sulcal
Microhemorragias
3. EFECTOS SECUNDARIOS
La labor de limpieza del lecanemab puede provocar una irritación, una inflamación al intentar despegar las placas amiloides o una hemorragia si la zona en la que incide es sobre los vasos sanguíneos.
¿Qué son las ARIA?
2-3%
Son cambios en el cerebro visibles en la resonancia magnética que pueden ocurrir después del uso de anticuerpos amiloides.
de los pacientes favorece la inflamación del cerebro y riesgo de sangrado (ictus)
ARIA-E
ARIA-H
(edema)
(hemorragia)
Edema y/o derrame sulcal
Microhemorragias
Ese 2% o 3% de riesgos incluye también el de sangrado, es decir de derrame cerebral. Para evitar uno y otro, la guía de práctica clínica desarrollada para el uso de lecanemab plantea la realización por protocolo de una serie de resonancias magnéticas, que permitirán detectar a los pacientes de riesgo y reacondicionar la terapia. «Si vemos que se producen, podremos actuar lo antes posible».
¿Y ahora, qué?
¿Realmente vale para algo un fármaco que sólo puede utilizarse durante un tiempo en un momento temprano de la enfermedad? Aunque a simple vista parezca un contrasentido la respuesta es un sí rotundo. No sólo porque disponer de un primer medicamento abre las puertas al desarrollo de otros mejores. Frente al VIH/sida, por ejemplo, la triple terapia antirretroviral que salvó la vida de los infectados en 1996 obligaba a muchos pacientes a tomar de 15 a 20 pastillas al día. Hoy el panorama es radicalmente distinto. Está a punto de aparecer un tratamiento consistente en una única píldora para ser tomada una vez al año.
En un futuro, el desarrollo de lecanemab, en línea con este ejemplo, podría permitir no solo el diagnóstico temprano de la enfermedad, sino evitar también que el mal evolucionara hacia fases más avanzadas. No es una idea tan descabellada. La detección en sangre mediante análisis de las proteínas tau y amiloide ya es posible. «Otra cosa es que en general no se recomiende, porque a día de hoy no podemos hacer nada; pero ¿y si podemos frenar la enfermedad? El puzzle es complejo y faltan muchas incógnitas por resolver. Por ejemplo: ¿actúa lecanemab o alguno de sus 'hijos' sobre la proteína tau? O otras aparentemente más sencillas: ¿qué problemas de memoria son atribuibles al alzheimer? El paso está dado. Parafraseando a Neil Amstrong tras alcanzar la Luna, de momento puede parecer pequeño para los pacientes, pero quizás sea grande para la humanidad.
Créditos
-
GRÁFICOS: Isabel Toledo
¿Tienes una suscripción? Inicia sesión